راهنمای مصور مدیریت کیفیت برای تجهیزات پزشکی و ISO 13485
راهنمای مصور مدیریت کیفیت برای تجهیزات پزشکی و ISO 13485
مدیریت کیفیت برای دستگاه های پزشکی به سیستم ها و فرآیندهایی اطلاق می شود که برای اطمینان از ایمن بودن، موثر بودن و برآورده شدن الزامات نظارتی دستگاه های پزشکی به کار گرفته می شوند. استاندارد ISO 13485 شامل الزامات مدیریت کل چرخه عمر یک دستگاه پزشکی، از طراحی و توسعه گرفته تا ساخت، توزیع و نظارت پس از فروش است. این راهنمای مصور توسط Peter Sebelius، یکی از اعضای گروه کاری مشترک که آخرین نسخه های ISO 13485 و ISO 14971 را نوشته است، نوشته شده است.
این راهنما:
ارائه یک نمای کلی مفید از مدیریت کیفیت و ISO 13485،
توضیح واژگان مورد استفاده در استاندارد
به باورهای غلط رایج رسیدگی میکند
چرا مدیریت کیفیت تجهیزات پزشکی مهم است؟
مدیریت کیفیت تجهیزات پزشکی نه تنها برای فروش محصولاتی که نیازهای مشتری را برآورده میکند، مهم است بلکه در صنعت تجهیزات پزشکی، مدیریت کیفیت برای رعایت مقررات و دسترسی به بازار نیز مهم است. سازمانهای تجهیزات پزشکی باید مقررات مختلفی را رعایت کنند تا اطمینان حاصل کنند که دستگاههایشان الزامات کیفی خاصی را برآورده میکنند. استاندارد ISO 13485 استاندارد مهمی است و میتواند برای برآوردن الزامات مقررات مورد استفاده قرار گیرد.
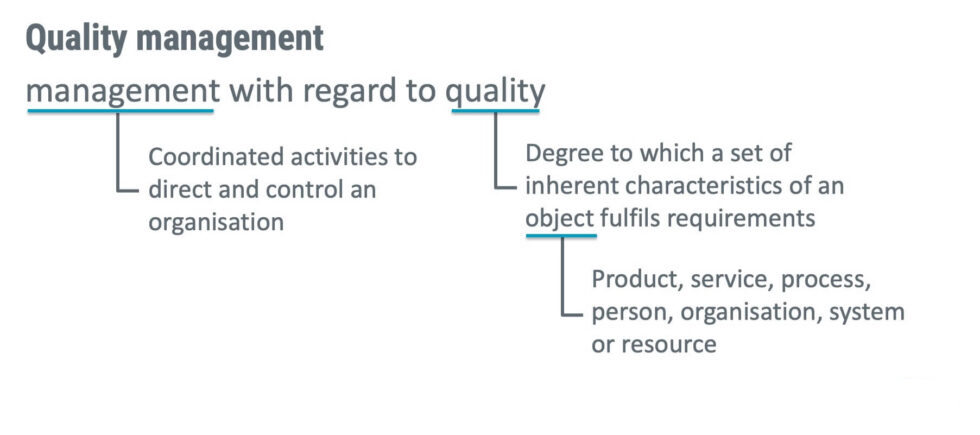
مدیریت کیفیت چیست؟
هنگامی که تعاریف اصطلاحات کلیدی در ISO 13485 وجود ندارد، ابتدا نباید به فرهنگ لغت مراجعه کنید، بلکه باید ISO 9000:2015 سیستم های مدیریت کیفیت - مبانی و واژگان را مطالعه کنید. در ISO 9000:2015، مدیریت کیفیت به عنوان «مدیریت با توجه به کیفیت» تعریف شده است. این تعریف به ویژه مفید نیست، اما اگر اصطلاحات تعریف بسط داده شوند، منطقی تر است. استاندارد ایزو ۹۰۰۰ ویرایش ۲۰۱۵ یک سیستم مدیریت کیفیت را پیشنهاد می دهد که به خوبی تعریف شده و مبتنی بر چهارچوبی است که مفاهیم اساسی، اصول، فرآیندها و منابع تعیین شده مرتبط با کیفیت را به منظور کمک به سازمان ها برای تحقق اهداف آن ها منسجم می کند. مدیریت کیفیت را می توان به عنوان هماهنگ کننده فعالیت ها برای هدایت و کنترل یک سازمان با توجه به برآورده کردن الزامات یک محصول، خدمات، فرآیند یا سیستم در نظر گرفت.
سیستم مدیریت کیفیت (QMS) چیست؟
سیستم مدیریت کیفیت یا به اختصار QMS، مجموعه ای از فرایندهاهستند که مشخصا بر برآورده ساختن نیازهای مشتریان متمرکز شدهاند. این سیستم همسو با اهداف استراتژیک سازمان است. این سیستم بیان کننده اهداف، خط مشی، فرایندها، مستندات و منابع مورد نیاز برای پیادهسازی و نگهداری آن است کار موفقیت آمیز با مدیریت کیفیت بدون سیستم مدیریت کیفیت یا QMS عملا غیرممکن است.
QMS مجموعه ای از سیاست ها، فرآیندها و رویه هایی است که توسط یک سازمان با هدف اصلی مدیریت کیفیت اجرا می شود. ISO 9001:2015 استاندارد بین المللی است که تمامی الزامات مورد نیاز برای پیاده سازی یک سیستم مدیریت کیفیت را مشخص می کند.
الزامات مدیریت کیفیت برای تجهیزات پزشکی در اتحادیه اروپا:
تمام تجهیزات پزشکی که در بازار اتحادیه اروپا قرار می گیرند باید الزامات قانونی اتحادیه اروپا را برآورده کنند. این امر توسط مقررات تجهیزات پزشکی (MDR) و مقررات دستگاه پزشکی تشخیصی آزمایشگاهی (IVDR) الزامی شده است. بخش 9 در ماده 10 MDR/IVDR به وضوح قید میکند که سازمانها باید یک سیستم مدیریت کیفیت را ایجاد، مستندسازی، پیادهسازی، نگهداری، بهروز نگهداشتن و به طور پیوسته سیستم مدیریت کیفیت را بهبود ببخشد. مقررات تجهیزات پزشکی اروپا ( MDR (Medical Device Regulation نه تنها به تجهیزات پزشکی می پردازد بلکه شامل محصولات زیبایی و آرایشی نیز می شود.
چه محصولات آرایشی شامل مقررات ( MDR( Medical Device Regulation می شوند؟
- لنزهای تماسی رنگی
- تجهیزات لیپوساکشن
- ایمپلنتهای کلاژن
- دستگاههای پاک کننده ی تتو
- مواد پرکننده تزریقی پوست مانند ژل و فیلر
- تجهیزات لیزری یا دستگاههای نور شدید پالسی (ضربانی) برای برداشتن موهای زائد
- تجهیزات جوان کننده پوست
ISO 13485: راهنمای دقیق برای سیستم های مدیریت کیفیت:
در حالی که MDR و IVDR الزامات مدیریت کیفیت سطح بالایی را ارائه میکنند، ISO 13485 عمیقتر به جزئیات میپردازد. استاندارد ISO 13485 هفتاد صفحه است، برخلاف MDR که در مجموع حدود 170 صفحه است، اما فقط شامل حدود یک صفحه با الزامات خاص در سیستم مدیریت کیفیت است.
ISO 13485 با MDR و IVDR هماهنگ شده است. هماهنگی ISO 13485 به این معنی است که اگر الزامات ISO 13485 برآورده شود، می توان فرض کرد که الزامات مربوط به MDR و IVDR نیز برآورده شده است.

الزامات مدیریت کیفیت برای تجهیزات پزشکی در ایالات متحده:
اتحادیه اروپا به ترتیب دو مقررات مختلف برای دستگاههای پزشکی (MDR) و دستگاههای پزشکی تشخیصی آزمایشگاهی (IVDR) دارد، در ایالات متحده، هم دستگاههای پزشکی و هم دستگاههای پزشکی تشخیصی آزمایشگاهی مشمول مقررات یکسانی هستند. 21 CFR 820 یا مقررات سیستم کیفیت (QSR).
سازمان غذا و دارو (FDA) به طور فعال در جهت همسویی مقررات سیستم کیفیت با ISO 13485 کار می کند. مقررات حاصل، پس از تحقق، به عنوان مقررات سیستم مدیریت کیفیت (QMSR) نامیده می شود. معادل استانداردهای هماهنگ در زمینه ایالات متحده، استانداردهای اجماع شناخته شده است. ISO 13485 یک استاندارد اجماع شناخته شده برای بازار ایالات متحده نیست، زیرا QSR شامل الزامات در همان زمینه های ISO 13485 است.
الزامات ISO 13485 در سیستم های مدیریت کیفیت:
QMS باید به گونه ای مستند و پیاده سازی شود که متناسب با اندازه و پیچیدگی سازمان و انواع دستگاه های پزشکی تولید شده باشد. استاندارد ISO 13485 را می توان برای هر چیزی از یک شرکت یک نفره تا یک شرکت چند ملیتی با هزاران کارمند اعمال کرد.
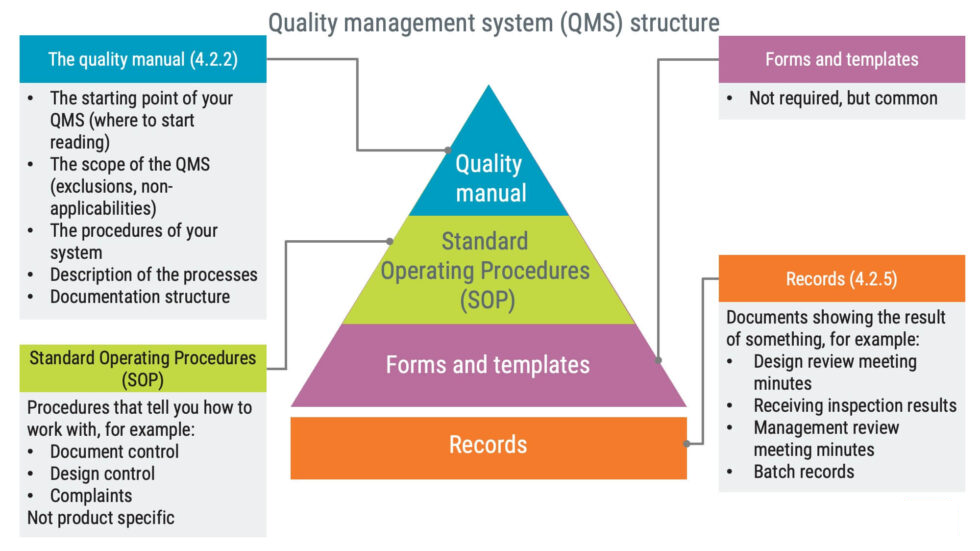
ISO 13485 همچنین می تواند برای شرکت هایی با انواع مختلف عملیات اعمال شود. این می تواند یک شرکت مشاوره یا سازنده تجهیزات پزشکی پیچیده باشد. این بدان معنی است که تنها یک راه حل قابل قبول یا یک اندازه متناسب با همه QMS وجود ندارد که الزامات ISO 13485 را برآورده کند. برعکس، تعداد بی نهایت راه برای پیاده سازی الزامات ISO 13485 وجود دارد. QMS نباید مجموعه ای ثابت از اسناد باشد. برای اطمینان از اثربخشی مستمر آن باید به طور منظم بررسی و به روز شود. سازمان ها موظف به ایجاد یک کتابچه راهنمای کیفیت هستند. کتابچه راهنمای کیفیت، سند سطح بالا برای QMS و نقطه شروع برای دسترسی به سیستم مدیریت کیفیت (QMS) است.
دفترچه راهنمای کیفیت باید ساختار مستندات مورد استفاده در سیستم مدیریت کیفیت را مشخص کند. یک نمای کلی، مشابه آنچه در زیر ارائه شده است، اما بدون متون توضیحی، معمولاً برای برآورده کردن این نیاز استفاده می شود.
رویه های مستند مورد نیاز ISO 13485 :
- نقش هایی را که توسط سازمان تحت الزامات قانونی کاربردی پذیرفته شده است ( بند 1-1-4)
- رویکردی مبتنی بر ریسک برای کنترل فرآیندها (بند 4-1-2)
- روش اجرایی و سوابق صحه گذاری و به کارگیری نرم افزار کامپیوتری ( بند 6-1-4)
- سایر مستنداتی که توسط الزامات قانونی کاربردی مشخص شده ( بند 1-2-4)
- نظامنامه کیفیت ( بند 2-2-4)
- پرونده تجهیزات پزشکی ( بند 3-2-4)
- روش اجرایی کنترل مدارک (بند 4-2-4)
- روش اجرایی کنترل سوابق ( بند 5-2-4)
- خط مشی کیفیت ( بند 3-5)
- اهداف کیفیت ( بند 1-4-5)
- مسئولیت ها و اختیارات( بند 1-5-5)
- ارتباط متقابل بین کارکنانی که کارهای تاثیرگذار بر کیفیت را مدیریت، اجرا و تصدیق می نمایند ( بند 1-5-5)
- روش اجرایی بازنگری مدیریت ( بند 1-6-5)
- روش اجرایی آموزش ( بند 2-6)
- الزاماتی برای زیرساخت و فعالیت های نگهداری( بند 3-6)
- الزاماتی برای محیط کار ( بند 1-4-6)
- تمهیداتی برای کنترل آلودگی یا محصولاتی که در معرض آلودگی قرار دارند( بند 2-4-6)
- فرآیندی برای مدیریت ریسک در تحقق محصول ( بند 1-7)
- طرحریزی فرآیندهای تحقق محصول در تناسب با روس های عملیاتی سازمان( بند 1-7)
- ترتیباتی برای ارتباط با مشتری (بند3-2-7)
- روش اجرایی طراحی و توسعه ( بند 1-3-7)
- طرحریزی طراحی و توسعه ( بند 2-3-7)
- طرح های تصدیق ( بند 6-3-7) شامل روش ها، معیارهای پذیرش و در موارد مقتضی تکنیک های آماری
- نتایج و اثرات تصدیق طراحی و توسعه و فعالیت مورد نیاز ( بند 6-3-7)
- طرح های صحه گذاری (بند 7-3-7) شامل روش ها، معیارهای پذیرش و در موارد مقتضی تکنیک های آماری
- نتایج و صحه گذاری طراحی و توسعه و فعالیت های مورد نیاز ( بند 7-3-7)
- روش اجرایی برای انتقال خروجی های طراحی و توسعه به سازنده ( بند 8-3-7)
- روش اجرایی برای کنترل تغییرات طراحی و توسعه ( بند 9-3-7)
- روش اجرایی خرید ( بند 1-4-7)
- اطلاعات خرید ( بند 1-4-7)
- مستندات مرتبط با روش ها و شیوه های کنترل تولید ( بند 1-5-7)
- الزامات مرتبط با پاکیزگی محصول ( بند 2-5-7)
- روش اجرایی برای خدمات تجهیزات پزشکی ( بند 4-5-7)
- روش اجرایی صحه گذاری فرآیندها (بند 6-5-7)
- روش اجرایی برای صحه گذاری فرآیندهای استریل و سیستم های محافظ استریل( بند 7-5-7)
- روش اجرایی شناسایی حصول ( بند 8-5-7)
- سیستمی جهت تخصیص شناسه منحصر به فرد به تجهیز پزشکی (بند 8-5-7) چنانچه الزام قانونی باشد
- روش اجرایی جهت شناسایی تجهیز پزشکی برگشتی به سازمان و تمایز از سایر محصول نامنطبق( بند 8-5-7)
- روش اجرایی ردیابی محصول( بند 1-9-5-7) مطابق الزامات کاربردی
- روش اجرایی محافظت از انطباق محصول در طی فرآوری ، انبارش،جابجایی و توزیع ( 11-5-7)
- مستند نمودن الزامات برای شرایط ویزه در صورتی که بسته بندی به تنهای نتواند از محصول محافظت نماید(بند11-5-7)
- روش اجرایی کنترل تجهیزات پایش واندازه گیری ( بند 6-7)
- روش اجرایی برای صحه گذاری کاربرد نرم افزار کامپیوتر جهت استفاده در پایش و اندازه گیری ( بند 6-7)
- روش اجرایی بازخورد مشتری ( بند 1-2-8)
- روش اجرایی رسیدگی به شکایت ( بند 2-2-8)
- روش اجرایی برای اطلاع رسانی گزارش به قانون گذار ( بند 3-2-8)
- روش اجرایی ممیزی داخلی ( بند 4-2-8)
- روش اجرایی کنترل محصول نامنطبق ( بند 1-3-8)
- روش اجرایی صدور هشدارهای توصیه ای مطابق الزامات قانونی کاربردی ای در مواجهه با محصول نامنطبق شناسایی شده پس از ارسال ( بند 3-3-8 )
- روش اجرایی برای تحلیل داده ها ( بند 4-8)
- روش اجرایی اقدام اصلاحی ( بند 2-5-8)
- روش اجرایی اقدام پیشگیرانه ( بند 3-5-8)
